مستوى الطاقة الثانوي 4s أقل من طاقة المستوى الثانوي

مستوى الطاقة الثانوي 4s هو مستوى فرعي في الذرة يحتوي على إلكترونين كحد أقصى. وهو مستوى طاقة أعلى من مستوى الطاقة الثانوي 3d وأقل من مستوى الطاقة الثانوي 4p.

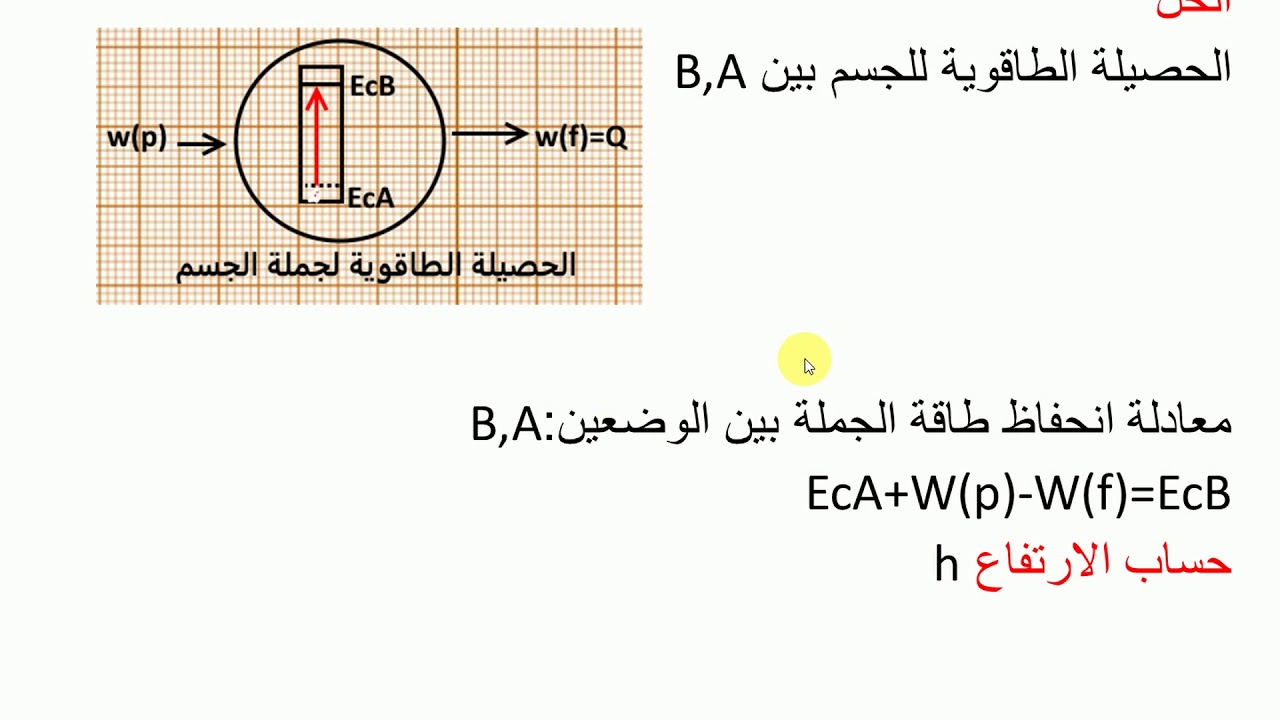
أعداد الكم والمدارات
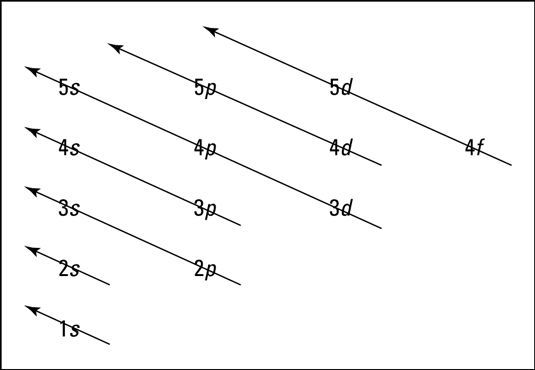
يتم تحديد مستوى الطاقة الثانوي 4s بواسطة عدد الكم الرئيسي (n = 4) ورقم الكم المغزلي (l = 0). يشير عدد الكم الرئيسي إلى مستوى الطاقة للذرة، ويشير رقم الكم المغزلي إلى الشكل العام للمدار. المدار s كروي الشكل.

تكوين الإلكترون
{ |}
|}
يمكن أن يحتوي مستوى الطاقة الثانوي 4s على إلكترونين كحد أقصى. يتم ملء المدارات بالإلكترونات وفقًا لمبدأ أوفباو، والذي ينص على أن الإلكترونات تشغل المدارات ذات الطاقة الأقل أولاً. لذلك، يتم ملء المدار 4s بعد ملء المدارات الفرعية 3s و3p و3d.
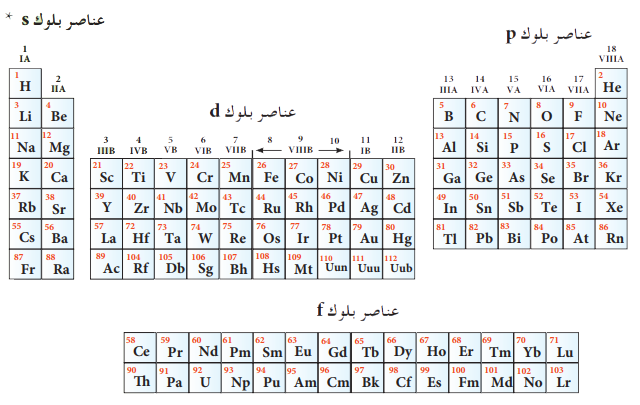
العناصر الكيميائية

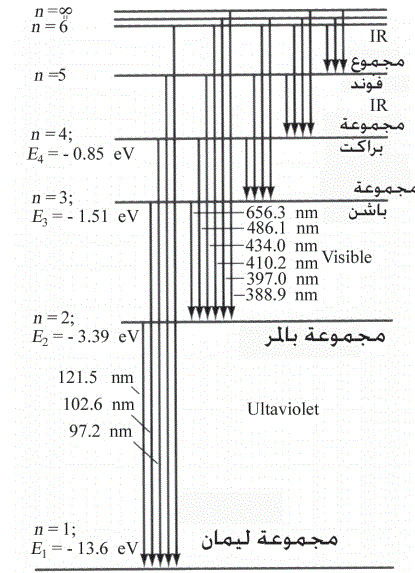
العناصر الكيميائية التي لها إلكترونات في مستوى الطاقة الثانوي 4s هي عناصر المجموعة الثامنة عشر (الغازات النبيلة). هذه العناصر مستقرة للغاية لأنها تحتوي على غلاف توزيع إلكتروني كامل، مما يعني أن جميع المدارات في مستويات الطاقة الرئيسية الأدنى ممتلئة.
{ |}
|}
خصائص العناصر

العناصر التي تحتوي على إلكترونات في مستوى الطاقة الثانوي 4s لها خصائص فيزيائية وكيميائية مميزة بسبب توزيعها الإلكتروني. على سبيل المثال، غازات النبيلة عديمة اللون وعديمة الرائحة وغير متفاعلة.
التفاعلات الكيميائية

بسبب الاستقرار العالي لغازات النبيلة، فإنها لا تميل إلى المشاركة في التفاعلات الكيميائية. ومع ذلك، يمكن أن تشكل بعض غازات النبيلة مركبات مع عناصر أخرى، مثل الزينون الذي يمكنه تكوين مركبات مع الأكسجين والفلور.

التطبيقات
{ |}
|}
تستخدم غازات النبيلة في مجموعة متنوعة من التطبيقات بسبب خصائصها الفريدة. على سبيل المثال، يستخدم الهيليوم في المناطيد والبالونات، ويستخدم النيون في مصابيح الفلورسنت، ويستخدم الأرجون في مصابيح الليزر.
{ |}
|}
الخلاصة

مستوى الطاقة الثانوي 4s هو مستوى فرعي مهم في الذرة حيث يمكن أن يحتوي على إلكترونين كحد أقصى. يلعب دورًا مهمًا في تحديد خصائص العناصر الكيميائية وتفاعلاتها وتطبيقاتها.
